La estructura de la materia es un tema fascinante que nos permite explorar los componentes fundamentales del universo que nos rodea. Desde la antigüedad, los científicos han buscado comprender cómo están organizados los átomos y moléculas que constituyen todo lo que vemos a nuestro alrededor.
En pocas palabras, la estructura de la materia se refiere a cómo los átomos se unen para formar moléculas y cómo estas moléculas se organizan para crear diferentes sustancias y materiales. Es como un rompecabezas en el que cada pieza tiene un papel esencial. Los átomos están compuestos por partículas aún más pequeñas llamadas protones, neutrones y electrones. Estas partículas interactúan entre sí a través de fuerzas electromagnéticas para dar lugar a la gran variedad de sustancias que existen en el mundo.
Pero, ¿por qué es importante comprender la estructura de la materia? Bueno, para empezar, nos ayuda a explicar muchas de las propiedades y comportamientos que observamos en los diferentes materiales. Por ejemplo, la diferencia entre un metal y un plástico radica en la forma en que sus átomos se organizan y se unen. Además, comprender la estructura de la materia también es fundamental para el desarrollo de nuevas tecnologías y materiales avanzados.
Dentro de la estructura de la materia, encontramos diferentes niveles de organización, desde los átomos y las moléculas hasta las células y los materiales a gran escala. En los próximos párrafos exploraremos cada uno de estos niveles en más detalle, ¡así que mantente atento!
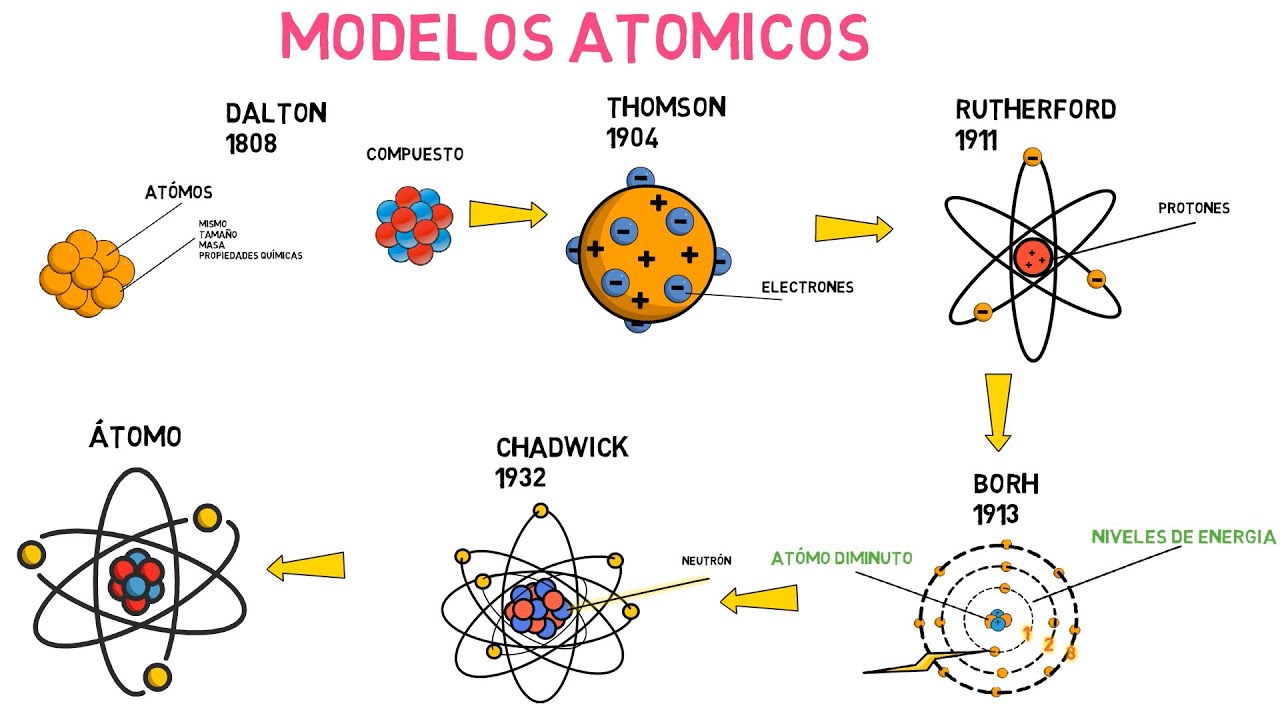
Los primeros modelos atómicos
Los primeros modelos atómicos fueron desarrollados a principios del siglo XX, cuando los científicos comenzaron a investigar la estructura interna de los átomos. Uno de los primeros modelos propuestos fue el modelo de Thomson, también conocido como el modelo del pudin de pasas. Este modelo describía al átomo como una esfera cargada positivamente con electrones incrustados en ella, similar a las pasas en un pudin.
Sin embargo, este modelo fue desafiado por el experimento de Rutherford, que mostró que la mayoría de las partículas alfa disparadas hacia una delgada lámina de oro pasaban a través de ella sin desviarse, indicando que los átomos eran en su mayoría espacio vacío. A partir de este experimento, Rutherford propuso su propio modelo atómico, conocido como el modelo planetario. En este modelo, los electrones giran alrededor del núcleo en órbitas similares a los planetas alrededor del sol.
Aunque el modelo de Rutherford fue un avance significativo, no explicaba la estabilidad de los átomos. Esto llevó a la propuesta del modelo de Bohr, que introdujo niveles de energía cuantizados en los que los electrones pueden existir. En este modelo, los electrones se distribuyen en órbitas específicas alrededor del núcleo y solo pueden saltar de un nivel de energía a otro.
Estos primeros modelos atómicos sentaron las bases para el desarrollo de la teoría cuántica y el modelo atómico actual, que considera a los electrones como partículas y ondas al mismo tiempo, y describe la probabilidad de encontrarlos en diferentes regiones alrededor del núcleo. A medida que avanzamos en nuestro entendimiento de los átomos, seguimos buscando nuevas formas de representar y comprender su estructura y comportamiento.
La revolución cuántica: el modelo de Bohr
En la inmensidad del mundo de la física, hay pocas teorías que hayan desafiado tanto nuestros conceptos tradicionales de la realidad como la teoría cuántica. Esta revolucionaria rama de la física nos invita a adentrarnos en un mundo intrigante y fascinante, donde las partículas pueden existir en múltiples estados al mismo tiempo, y donde la incertidumbre se convierte en una parte fundamental de la naturaleza misma.
Uno de los modelos más influyentes de la teoría cuántica es el modelo de Bohr, desarrollado por el físico danés Niels Bohr a principios del siglo XX. Este modelo postulaba que los electrones en un átomo solo podían ocupar ciertos niveles de energía discretos, y que al saltar de un nivel a otro, los electrones emitían o absorbían energía en forma de fotones.
Lo que hace al modelo de Bohr tan revolucionario es que desafía nuestras intuiciones clásicas sobre cómo deberían comportarse los electrones en un átomo. Según la física clásica, los electrones deberían orbitar alrededor del núcleo en trayectorias perfectamente definidas, al igual que los planetas alrededor del sol. Sin embargo, Bohr nos mostró que esta visión simplista no era correcta, y que el comportamiento de los electrones en realidad está gobernado por leyes completamente diferentes a las que estamos acostumbrados.
Al sumergirnos en el fascinante mundo de la teoría cuántica, nos encontramos con un sinfín de maravillas y paradojas que desafían nuestra comprensión de la realidad. El modelo de Bohr es solo el comienzo de un viaje en el que descubriremos fenómenos como la superposición cuántica, donde una partícula puede estar en múltiples lugares al mismo tiempo, y la entrelazación cuántica, donde partículas distantes parecen estar instantáneamente conectadas en un nivel fundamental.
La revolución cuántica es un campo que sigue en constante desarrollo, y el modelo de Bohr es solo uno de los muchos pilares sobre los que se basa nuestra comprensión actual. A medida que avanzamos en nuestra exploración del mundo cuántico, continuamos desafiando nuestras intuiciones y revelando nuevas y emocionantes formas en las que la naturaleza puede manifestarse. No te pierdas la próxima entrega de esta serie, donde exploraremos más a fondo los fundamentos de la teoría cuántica y nos adentraremos en los descubrimientos más recientes que están cambiando nuestra forma de ver el universo. ¡Prepárate para un viaje alucinante hacia lo desconocido!
Descubrimiento del modelo de nube electrónica
¿Alguna vez te has preguntado cómo están dispuestos los electrones en un átomo? ¿Cómo es posible que permanezcan orbitando alrededor del núcleo sin caer hacia adentro? Bueno, déjame presentarte el modelo de nube electrónica, una teoría que revolucionó nuestra comprensión de la estructura atómica.
Este fascinante descubrimiento se remonta a principios del siglo XX, cuando los científicos estaban tratando de reconciliar las observaciones experimentales con la teoría clásica de la física. Fue entonces cuando de manera ingeniosa, el químico danés Niels Bohr propuso su modelo, que postulaba que los electrones se movían en órbitas estables alrededor del núcleo del átomo.
Sin embargo, a medida que avanzaba la investigación, los científicos descubrieron que este modelo tenía limitaciones. No era capaz de explicar ciertos fenómenos, como la interferencia y la difracción de electrones. Fue así como se aclaró que los electrones en realidad no se movían en órbitas precisas, sino que existían en una especie de «nube» que rodeaba al núcleo.
La nube electrónica se refiere a la probabilidad de encontrar un electrón en diferentes puntos espaciales alrededor del núcleo. A medida que nos alejamos del núcleo, la probabilidad de encontrar electrones disminuye gradualmente. Esto nos lleva al concepto de «capas» o niveles de energía, donde los electrones pueden existir.
Este modelo de nube electrónica ha sido crucial para entender la química y las reacciones químicas. También es importante tener en cuenta que la nube electrónica no es una representación literal de los electrones, sino una forma de describir su comportamiento probabilístico. Esto nos permite comprender mejor la estructura atómica y cómo interactúan los átomos entre sí.
En resumen, el descubrimiento del modelo de nube electrónica ha sido un hito importante en la historia de la ciencia. Nos ha ayudado a comprender mejor cómo los electrones se organizan dentro de los átomos y ha sentado las bases para muchas teorías y descubrimientos posteriores en la química y la física. Así que la próxima vez que te encuentres mirando al cielo nocturno, recuerda que dentro de tu cuerpo también hay una fascinante nube de electrones dando vida a la materia.
Avances recientes: el modelo de partículas elementales
En los últimos años, se han logrado avances significativos en el estudio del modelo de partículas elementales. Este modelo es fundamental para comprender la estructura y las interacciones de las partículas más pequeñas que componen el universo.
Un avance reciente en este campo ha sido el descubrimiento del bosón de Higgs en el Gran Colisionador de Hadrones (LHC). Esta partícula, predicha por el modelo estándar de la física de partículas, confirma la existencia de un campo de Higgs que le otorga masa a otras partículas.
Otro avance emocionante ha sido el estudio de neutrinos. Estas partículas subatómicas, que apenas interactúan con la materia, han revelado propiedades sorprendentes, como su capacidad para cambiar de sabor mientras viajan a través del espacio.
Además, los experimentos en aceleradores de partículas y observaciones astronómicas han proporcionado pistas sobre la existencia de partículas aún no descubiertas, como los neutrinos estériles y la materia oscura.
Estos avances en el modelo de partículas elementales nos acercan cada vez más a una comprensión completa de la naturaleza fundamental de la materia y el universo. Con investigaciones en curso y nuevas tecnologías en desarrollo, podemos esperar más descubrimientos emocionantes en el futuro cercano.