1. Los primeros pensamientos sobre el átomo
Cuando pensamos en átomos, es probable que nos vengan a la mente imágenes de pequeñas partículas indivisibles que componen la materia. Y aunque esta idea es cierta en cierta medida, el concepto de átomo ha evolucionado a lo largo de la historia de la ciencia. En los primeros días, los filósofos griegos ya especulaban sobre la existencia de partículas indivisibles que formaban la materia.
Uno de los primeros filósofos en promover la idea del átomo fue Leucipo, quien argumentó que todo estaba compuesto por partículas indivisibles llamadas átomos. Estas partículas eran eternas e indivisibles, y existían en un espacio vacío. Sin embargo, fue su discípulo, Demócrito, quien llevó esta idea un paso más allá al describir los átomos como diferenciados en forma y tamaño, lo que determinaba las propiedades de la materia.
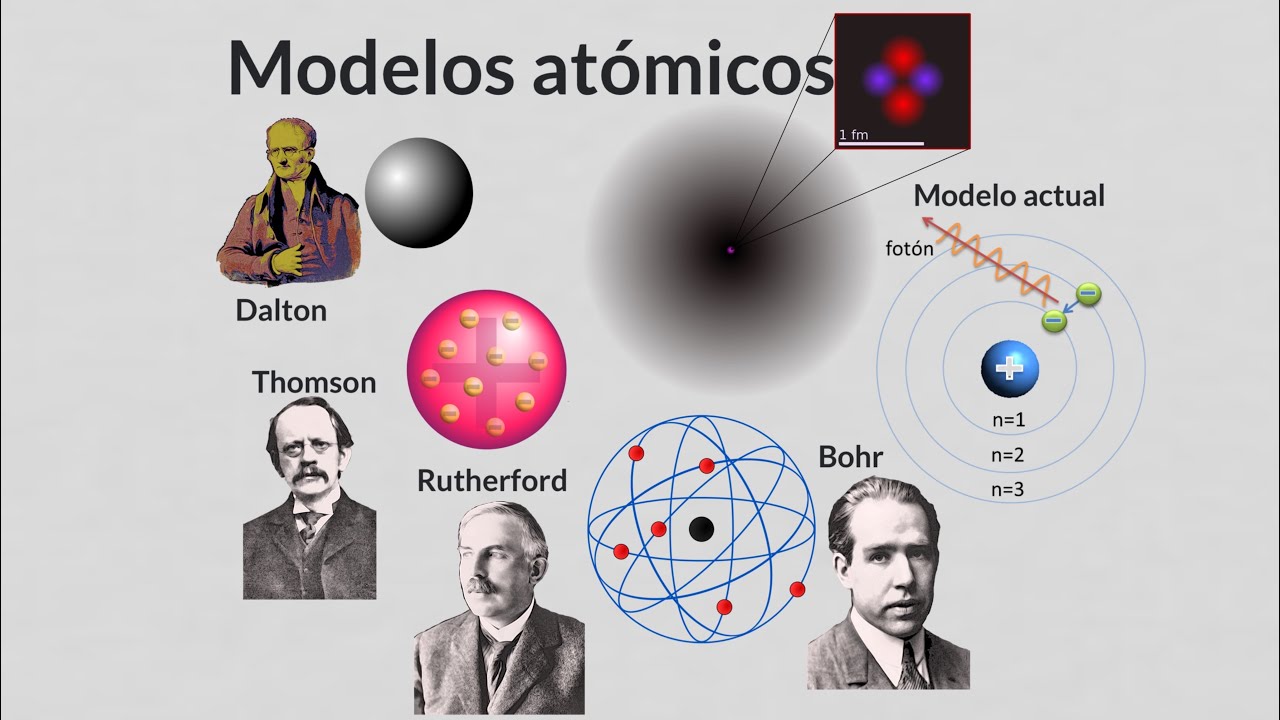
Con el tiempo, los pensamientos sobre el átomo evolucionaron a medida que se descubrían nuevos hallazgos científicos. En el siglo XIX, John Dalton desarrolló la teoría atómica moderna, en la cual postulaba que los átomos eran las unidades básicas de la materia y que cada elemento estaba compuesto por un tipo específico de átomo. Esta teoría sentó las bases para la comprensión actual del átomo y permitió avances significativos en áreas como la química y la física.
Como podemos ver, la historia del átomo es fascinante y llena de descubrimientos científicos que han revolucionado nuestra comprensión del mundo que nos rodea. A lo largo de los siglos, los pensamientos y teorías sobre el átomo han evolucionado, y hoy en día, gracias a tecnologías como el microscopio de electrones, podemos observar y estudiar los átomos a nivel microscópico. Esto nos ha llevado a avances increíbles en campos como la nanotecnología y la medicina.
2. Los experimentos de la química antigua
En la historia de la química, los experimentos de la antigüedad han jugado un papel fundamental en la comprensión de los componentes y procesos químicos. Estos experimentos, aunque en muchos casos rudimentarios en comparación con los métodos modernos, sentaron las bases de los descubrimientos posteriores.
Una de las figuras más destacadas en la química antigua fue el alquimista y médico persa Avicena. Sus experimentos se centraron en la destilación y la extracción de sustancias naturales, lo que le permitió descubrir propiedades químicas clave de ciertos elementos y compuestos. Por ejemplo, fue el primero en destilar el alcohol, lo que abrió un nuevo campo de estudio en la química de bebidas alcohólicas.
Otro experimento famoso de la química antigua fue el realizado por el filósofo griego Demócrito, quien postuló la idea de que la materia estaba compuesta por partículas indivisibles llamadas átomos. Si bien su experimento no fue en el sentido moderno de la palabra, planteó la idea de que la materia estaba formada por unidades más pequeñas y abrió el camino a futuras investigaciones en la estructura de la materia.
Estos ejemplos demuestran cómo los experimentos de la química antigua sentaron las bases para las teorías y descubrimientos posteriores. Aunque los métodos han evolucionado a lo largo de los siglos, es importante reconocer la contribución de aquellos pioneros que se aventuraron en lo desconocido y sentaron las bases para la ciencia que conocemos hoy en día.
3. Descubrimiento del electrón
El descubrimiento del electrón fue un hito clave en la historia de la ciencia, que revolucionó la comprensión de la estructura y composición de la materia. Este importante avance se produjo a fines del siglo XIX, gracias a los experimentos del físico británico J.J. Thomson.
Thomson realizó numerosos experimentos en su laboratorio, uno de los cuales implicaba el uso de tubos de rayos catódicos, que en ese entonces eran un fenómeno intrigante y misterioso. Estos tubos, que contenían un gas a baja presión, generaban un rayo de luz que se movía en línea recta desde el cátodo hacia el ánodo.
Sin embargo, durante uno de sus experimentos, Thomson notó algo sorprendente: cuando se aplicaba una fuerte carga eléctrica al tubo, el rayo se curvaba en la dirección opuesta al ánodo. Este fenómeno inesperado llevó a Thompson a concluir que los rayos estaban compuestos por partículas subatómicas con carga negativa, a las que llamó electrones.
Esta revelación marcó un punto de inflexión en la comprensión de la estructura subatómica y condujo al modelo del átomo propuesto por Thomson, conocido como “pastel de pasas”. Según este modelo, el átomo era una esfera positiva con electrones incrustados en ella. Si bien este modelo ha sido superado por nuevas teorías y descubrimientos, el descubrimiento del electrón sentó las bases para nuestra comprensión actual de la estructura atómica.
¿Cómo se descubre el electrón?
El descubrimiento del electrón fue posible gracias a la exploración de los rayos catódicos en los tubos de vacío. Estos rayos se generan al aplicar un fuerte voltaje a través de un gas a baja presión, creando un flujo de partículas cargadas negativamente que se mueven desde el cátodo hacia el ánodo.
Thomson notó que estos rayos tenían la capacidad de curvarse en presencia de un campo eléctrico o magnético. Al analizar esta curvatura, pudo determinar la relación entre la carga y la masa de estas partículas y descubrió que su carga era negativa. Esto llevó a la conclusión de que existían partículas subatómicas con carga negativa, a las que llamó electrones.
El descubrimiento del electrón fue un avance fundamental en la comprensión de la estructura atómica y abrió la puerta para futuras investigaciones sobre la naturaleza de la materia.
Curiosidades sobre el electrón
– El electrón es una partícula elemental, es decir, no se ha descubierto que esté compuesto por partículas más pequeñas.
– Los electrones son extremadamente pequeños, su masa es aproximadamente 1836 veces menor que la de un protón o un neutrón.
– Aunque los electrones tienen carga negativa, la carga total de un átomo es neutral debido a que también existen partículas con carga positiva, como los protones en el núcleo.
– Los electrones son responsables de los enlaces químicos entre los átomos, ya que su movimiento y distribución determinan la formación de compuestos químicos.
– Los electrones también juegan un papel crucial en la generación de electricidad y en el funcionamiento de dispositivos electrónicos, como los ordenadores y los teléfonos móviles.
¡El descubrimiento del electrón sin duda ha cambiado nuestra comprensión del mundo a nivel subatómico y ha abierto las puertas a innumerables avances tecnológicos que disfrutamos hoy en día!
4. Modelo atómico de Rutherford
El modelo atómico de Rutherford, propuesto por el científico neozelandés Ernest Rutherford en 1911, revolucionó nuestra comprensión sobre la estructura del átomo. Después de realizar experimentos con partículas alfa, Rutherford llegó a la conclusión de que el átomo consiste en un núcleo pequeño y denso en el centro, rodeado por una nube de electrones en constante movimiento.
Para comprender cómo Rutherford desarrolló su modelo, vamos a imaginar que estamos en su laboratorio. Rutherford estaba interesado en investigar la estructura interna del átomo y decidió realizar un experimento utilizando partículas alfa, que son partículas cargadas positivamente. Estas partículas alfa fueron disparadas hacia una lámina de oro ultra delgada.
Lo que Rutherford esperaba encontrar era que las partículas alfa pasaran directamente a través de la lámina de oro, ya que según el modelo atómico previo, el “budín de pasas” propuesto por Joseph Thomson, se creía que los electrones estaban dispersos de manera uniforme en el átomo. Sin embargo, los resultados sorprendieron a Rutherford. La mayoría de las partículas alfa pasaron a través de la lámina sin ser desviadas, pero algunas sufrieron una desviación significativa e incluso fueron reflejadas en ángulos inesperados.
Estas observaciones llevaron a Rutherford a concluir que dentro del átomo existe un núcleo pequeño y cargado positivamente, que es responsables de desviar las partículas alfa. Además, la mayoría de la masa del átomo está concentrada en este núcleo. En contraste, los electrones se encuentran en una nube a gran distancia del núcleo y se mueven alrededor de él en órbitas.
En resumen, el modelo atómico de Rutherford nos ayuda a entender la estructura básica de los átomos: un núcleo positivo en el centro y electrones girando alrededor en órbitas. Este modelo sentó las bases para desarrollar modelos posteriores más refinados que tomaron en cuenta la mecánica cuántica.
5. La revolución cuántica y el modelo actual del átomo
¡Bienvenidos a otro emocionante artículo sobre el fascinante mundo de la ciencia! En esta ocasión, vamos a sumergirnos en la revolución cuántica y descubrir cómo ha transformado nuestro modelo actual del átomo.
Antes de adentrarnos en el tema, vamos a repasar rápidamente lo que aprendimos en artículos anteriores. ¿Recuerdan el modelo de átomo de Dalton con sus bolitas indivisibles? Bueno, resulta que ese modelo fue reemplazado por el modelo de Thomson, quien descubrió los electrones. Pero, ¿qué hay de los protones y neutrones?
Aquí es donde la revolución cuántica entra en juego. A principios del siglo XX, científicos como Planck y Einstein revolucionaron nuestra comprensión de la realidad al descubrir que la energía no se transmite de manera continua, sino en pequeñas unidades llamadas cuantos. Esto es lo que llamamos “cuantificación”.
Ahora, ¿qué tiene esto que ver con el átomo? Resulta que el modelo actual del átomo se basa en la teoría cuántica, que incorpora la idea de que los electrones orbitan el núcleo en niveles de energía discretos. Estos niveles se llaman orbitales.
Los orbitales son como los estantes de una biblioteca, cada uno con un número limitado de libros (electrones). Ahora, aquí viene lo interesante: los libros no pueden ocupar cualquier posición en el estante, sino solo ciertos lugares específicos. Esto se debe al principio de exclusión de Pauli, que establece que en un orbital solo pueden haber dos electrones y deben tener espines opuestos.
Esta nueva visión del átomo fue posible gracias a la teoría cuántica, que es, sin duda, uno de los mayores logros de la ciencia moderna. Nos permite entender mejor cómo funciona el mundo a nivel microscópico y ha dado lugar a innumerables aplicaciones en campos como la electrónica y la medicina.
¿Increíble, verdad? La revolución cuántica ha transformado por completo nuestro modelo del átomo, llevándonos a una comprensión mucho más profunda de la materia y el universo en general. ¿Qué les parece esto? ¡Déjenme saber en los comentarios si les gustaría aprender más sobre este tema emocionante!
Algunas curiosidades sobre la teoría cuántica y el modelo actual del átomo:
- El principio de incertidumbre de Heisenberg establece que es imposible conocer simultáneamente con precisión la posición y el momento de una partícula.
- El modelo actual del átomo también es conocido como el modelo de Bohr, en honor al científico danés Niels Bohr, quien fue uno de los principales contribuyentes a este campo.
- Los electrones no se mueven como planetas alrededor del Sol en órbitas circulares, sino que tienen formas más complejas y se comportan tanto como partículas como ondas de energía.
- La teoría cuántica ha demostrado que las partículas subatómicas pueden estar en varios estados a la vez, lo que conocemos como superposición cuántica.
¡Espero que hayan disfrutado de este viaje acelerado a través de la revolución cuántica y el modelo actual del átomo! Recuerden que la ciencia siempre está en constante evolución, por lo que seguiremos descubriendo nuevos y emocionantes conocimientos en el futuro. ¡No se olviden de suscribirse para estar al tanto de futuros artículos científicos!