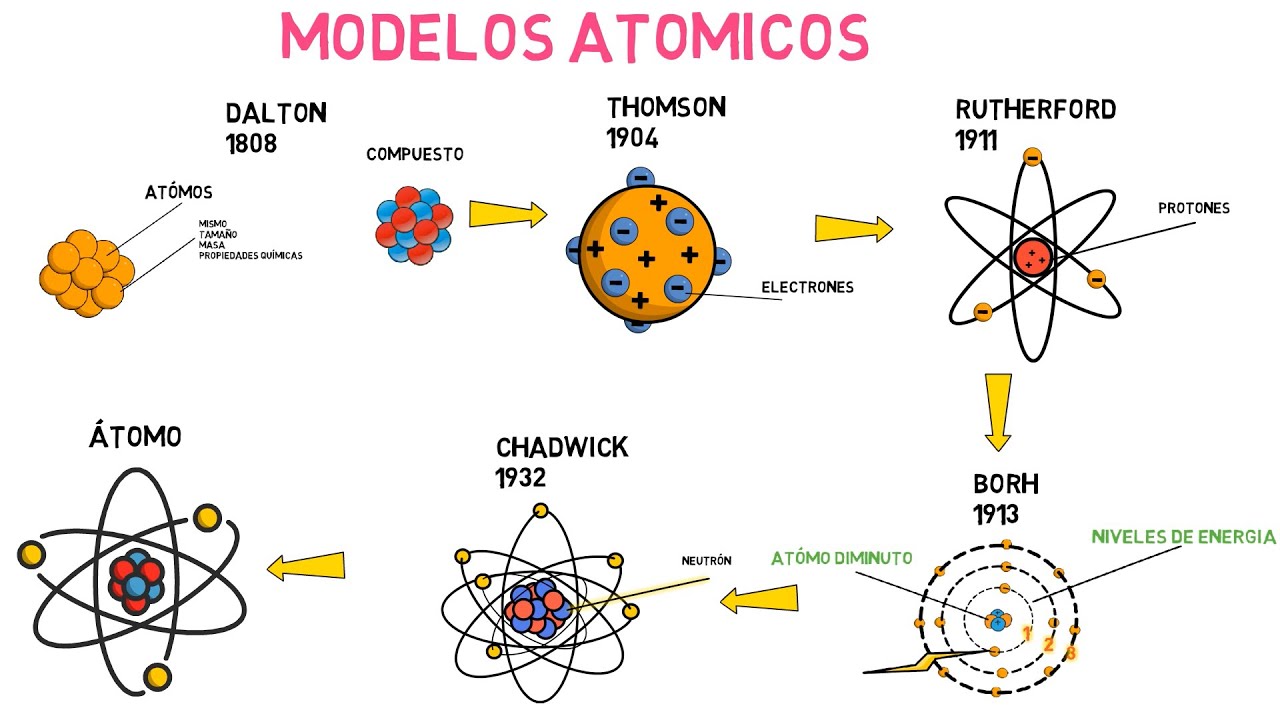
Modelo Atómico de Dalton
El Modelo Atómico de Dalton, propuesto en el siglo XIX por John Dalton, fue uno de los primeros intentos de entender la estructura básica de la materia. Dalton postuló que los átomos eran las unidades fundamentales de la materia y que cada elemento estaba compuesto por átomos únicos. Esta idea revolucionaria sentó las bases de la química moderna y allanó el camino para descubrimientos posteriores en el campo de la física cuántica.
Según el modelo de Dalton, los átomos eran partículas indivisibles y no se podían crear ni destruir. Además, se creía que los átomos de un elemento específico eran idénticos en tamaño, forma y propiedades, mientras que los átomos de diferentes elementos tenían características distintas. Esto explicaba por qué los distintos elementos exhibían diferentes propiedades químicas y físicas.
Aunque el Modelo Atómico de Dalton sirvió como base para nuestra comprensión inicial de la estructura atómica, con el avance de la tecnología y los experimentos, se descubrió que los átomos en realidad estaban compuestos de partículas subatómicas más pequeñas, como protones, neutrones y electrones. Esto llevó al desarrollo de modelos atómicos más complejos y precisos, como el modelo de Rutherford y el modelo de Bohr.
A pesar de los avances posteriores, el Modelo Atómico de Dalton sigue siendo una parte importante de la historia de la ciencia y sentó las bases para nuestra comprensión actual de la estructura de la materia. Es un recordatorio de cómo las ideas revolucionarias y audaces pueden cambiar nuestro conocimiento y abrir el camino hacia nuevos descubrimientos en el mundo de la ciencia.
Características principales del Modelo Atómico de Dalton:
– Los átomos son las unidades fundamentales e indivisibles de la materia.
– Los átomos de un elemento específico son idénticos y tienen las mismas propiedades.
– Los átomos de diferentes elementos tienen propiedades distintas.
– Los átomos no se pueden crear ni destruir durante las reacciones químicas.
Ejemplo de aplicación del Modelo Atómico de Dalton:
Imagina que tienes una muestra de agua compuesta por moléculas de hidrógeno y oxígeno. Según el Modelo Atómico de Dalton, cada molécula de agua estaría formada por un átomo de oxígeno y dos átomos de hidrógeno. Estos átomos se unirían mediante enlaces químicos para formar la molécula de agua. Este ejemplo ilustra cómo el Modelo Atómico de Dalton nos permite entender cómo los átomos se combinan para formar compuestos químicos.
Modelo Atómico de Thomson
Si hablamos de la historia de la ciencia, no podemos dejar de mencionar el Modelo Atómico de Thomson, propuesto por el físico inglés J.J. Thomson a fines del siglo XIX. Este modelo, también conocido como modelo del «budín de pasas», revolucionó nuestra comprensión de la estructura del átomo y nos ayudó a sentar las bases para futuros descubrimientos en el campo de la física cuántica.
Según Thomson, el átomo estaba compuesto por una masa positiva uniformemente distribuida, en la cual estaban incrustados los electrones de carga negativa de manera similar a las pasas en un budín. Esta idea desafiaba la noción prevaleciente en ese momento de que los átomos eran indivisibles y sin composición interna.
En aquellos tiempos, este enfoque tan novedoso fue recibido con gran aceptación, ya que explicaba fenómenos como la conducción de la electricidad a través de gases raros y los rayos catódicos. No obstante, el modelo de Thomson fue reemplazado más tarde por el famoso Modelo Atómico de Rutherford, que incorporó la noción de un núcleo atómico denso y cargado positivamente rodeado por electrones en órbita.
A pesar de haber quedado en el pasado, el Modelo Atómico de Thomson sigue siendo importante en la historia de la ciencia. Nos ayuda a apreciar cómo los científicos construyen y modifican sus teorías a medida que se hacen nuevos descubrimientos. Además, este modelo sentó las bases para el estudio de la estructura y comportamiento de los átomos, lo cual es fundamental en nuestra comprensión de la materia y la química.
En resumen, el Modelo Atómico de Thomson fue una de las primeras teorías que desafió las ideas preexistentes sobre la naturaleza de los átomos. Aunque haya sido reemplazado por modelos posteriores, su importancia en la historia de la ciencia es innegable. Nos enseña cómo la ciencia avanza mediante descubrimientos y nuevas interpretaciones de los fenómenos naturales.
Modelo Atómico de Rutherford
Hola amigos y amigas, en esta ocasión vamos a adentrarnos en el fascinante mundo del modelo atómico de Rutherford. Seguramente has escuchado hablar sobre los átomos y cómo están formados, pero el modelo propuesto por Rutherford en el año 1911 revolucionó nuestra comprensión de la estructura de la materia. ¡Así que prepárate para un viaje al microcosmos!
Antes de adentrarnos en los detalles del modelo de Rutherford, vamos a dar un vistazo rápido a lo que se creía anteriormente. En aquel entonces, el modelo atómico aceptado era el conocido como modelo de «budín de pasas» propuesto por Thomson. Según esta teoría, el átomo era una esfera positiva en la que los electrones estaban dispersos como pasas en un pudín. Sin embargo, los experimentos de Rutherford demostraron que esta idea no era del todo precisa.
Entonces, ¿en qué consiste el modelo atómico de Rutherford? Bien, Rutherford llevó a cabo una serie de experimentos con partículas alfa, que son núcleos de helio cargados positivamente. Estas partículas fueron disparadas hacia una lámina de oro ultradelgada. Se esperaba que las partículas atraviesen la lámina sin dificultad, según el modelo de «budín de pasas». Pero lo que Rutherford observó fue totalmente sorprendente.
Una gran cantidad de partículas alfa pasaban a través de la lámina, tal como se esperaba. Sin embargo, algunas partículas rebotaban de manera inesperada, incluso en ángulos muy diferentes a los esperados. Esto llevó a Rutherford a concluir que los átomos debían tener un núcleo muy pequeño y denso en su centro, que contenía la mayor parte de la masa y la carga positiva. Los electrones, por otro lado, girarían alrededor del núcleo, como planetas alrededor del sol.
Modelo Atómico de Bohr
¡Bienvenidos de nuevo! En esta ocasión vamos a sumergirnos en el fascinante mundo del Modelo Atómico de Bohr. Este modelo, propuesto por el físico danés Niels Bohr en 1913, fue un gran avance en nuestra comprensión de la estructura de los átomos y sentó las bases para la física cuántica.
Bohr postuló que los electrones en un átomo se mueven en órbitas alrededor del núcleo, más o menos como los planetas giran alrededor del sol. Sin embargo, a diferencia del sistema solar, donde las órbitas son continuas, Bohr propuso que las órbitas de los electrones en un átomo son cuantizadas, es decir, solo pueden tener ciertos valores específicos de energía. Esto significa que los electrones solo pueden existir en niveles de energía discreta.
Una de las implicaciones más interesantes del Modelo de Bohr es que los electrones pueden saltar de un nivel de energía a otro emitiendo o absorbiendo energía en forma de fotones. Esto explica por qué los átomos emiten y absorben luz en ciertos colores específicos. Por ejemplo, cuando un electrón salta de una órbita superior a una inferior, emite un fotón de luz visible. Esto nos permite ver colores distintos en los fuegos artificiales o en los tubos de neón.
En resumen, el Modelo Atómico de Bohr fue un hito importante en la comprensión de la estructura de los átomos. Nos ayudó a entender cómo los electrones se organizan en niveles de energía discretos y cómo interactúan con la luz. Siguiendo esta línea de investigaciones, se desarrollaron modelos aún más sofisticados, pero el enfoque de Bohr sigue siendo fundamental en la física cuántica. ¡Sorprendente, ¿verdad?
Modelo Atómico Actual
Después de años de investigación y descubrimientos, el modelo atómico actual se ha convertido en una representación más precisa y completa de cómo están estructurados los átomos. Atrás quedaron las teorías iniciales de los antiguos filósofos griegos que proponían que el átomo era indivisible. Ahora sabemos que los átomos están compuestos por diferentes partículas subatómicas: protones, neutrones y electrones.
El modelo atómico actual, conocido como modelo de Schrödinger, se basa en la teoría cuántica y describe los electrones como partículas con características de onda. Según este modelo, los electrones no siguen órbitas fijas alrededor del núcleo, sino que se encuentran en regiones de alta probabilidad llamadas orbitales. Estos orbitales determinan la distribución electrónica alrededor del núcleo y nos permiten entender las propiedades químicas de los elementos.
Hoy en día, contamos con tecnologías avanzadas como el microscopio de efecto túnel que nos permiten visualizar átomos individuales y estudiar su comportamiento. Esto ha revolucionado la forma en que entendemos el mundo microscópico y ha abierto nuevas puertas en la nanotecnología y la computación cuántica.
En resumen, el modelo atómico actual es un reflejo de los avances científicos y tecnológicos que hemos logrado a lo largo de la historia. Nos ha proporcionado una comprensión más profunda de la estructura de la materia y ha llevado al desarrollo de tecnologías revolucionarias. A medida que continuamos investigando y descubriendo, es emocionante pensar en las posibilidades futuras que el modelo atómico actual puede llevarnos.